
2023年1月,复星杏脉联合上海市第六人民医院梅炯主任团队合作开发的骨肿瘤深度学习算法技术的科研成果“Radiologists with assistance of deep learning can achieve overall accuracy of benign–malignant differentiation of musculoskeletal tumors comparable with that of pre-surgical biopsies in the literature(在深度学习的辅助下,放射科医生对肌肉骨骼肿瘤的良恶性鉴别率具有与文献中术前活检同等的准确性)”,获得国际权威期刊《International Journal of Computer Assisted Radiology and Surgery》(IF影响因子:3.4211)发表。

恶性骨肿瘤早期准确诊断极具挑战
基于MST罕见性和多样化的影像学特征
肌肉骨骼肿瘤(musculoskeletal tumors, MST)具有高度异质性,其中恶性肿瘤约占所有恶性肿瘤的1%[1,2]。因为该肿瘤的罕见性和多样化的影像学特征,恶性MST的早期准确诊断对于放射科医生来说是一个挑战[3]!据报道,只有31%的骨肉瘤和19%的尤文肉瘤在患者第一次就诊时被怀疑为骨肿瘤[4]。即使最初的诊断是准确的,MST患者仍然必须接受全面的实验室检查、放射学检查和活检,这使骨肉瘤从症状出现到开始治疗的时间延后了15周,而尤文肉瘤的时间延后了34周。
深度学习辅助诊断技术具有极大应用价值
减少骨肿瘤早期误诊率及提高诊断准确性
深度学习(deep learning, DL)医学诊断具有极大的应用价值,可以在分析医学影像时给医生提供建议,减少医生对病人病症产生误判的错误率。所以,将深度学习运用于骨肿瘤的诊断,对于减少骨肿瘤的早期误诊误治具有极大的研究意义和临床应用价值。
然而,迄今为止还没有关于如何使用DL算法提高MST诊断准确性的研究。为了弥补这一差距,复星杏脉联合上海市第六人民医院梅炯主任团队合作开发了骨肿瘤深度学习算法技术,测量出7名有超过15年经验的医生(1名放射科医生、2名肿瘤医生和4名骨科医生)[5]在DL模型辅助下的诊断效果均有提高。在本研究中,我们量化了4名放射科医生因使用该DL模型而导致的诊断准确性的提高,并将其提高的准确性与文献中报道的术前活检进行了比较。
我们首先对文献进行了系统回顾,通过综合符合纳入标准的文献数据,得到细针穿刺活检(fine needle aspiration biopsy, FNAB)和核心针活检(core needle biopsy, CNB)在区分良性和恶性MST方面各自的总体诊断准确性。为了与文献报道的准确性进行比较,我们邀请了3名普通放射科医生(A、B和C,分别有2年、6年和7年的放射诊断经验)和1名肌肉骨骼放射科医生(D,有33年的肌肉骨骼MRI经验),在有或没有DL模型辅助下,在我们自己的数据集(n = 62)上进行诊断试验。
我们采用了在骨肿瘤深度学习算法技术[5]中开发的数据集和DL模型,数据集包括304例MST患者的所有可用MR图像,包括DCE-MRI、T1-加权、T2 -加权、扩散加权成像(diffusion-weighted imaging, DWI)和对比增强T1-加权(contrast enhanced T1 weighted, CET1-w)序列。所有肿瘤根据术后病理报告或随访信息标记为恶性或良性。将患者按3:1:1的比例随机分为训练集、验证集和测试集。分别在三组MR的轴向、冠状面和矢状面图像上训练良恶性鉴别的DL模型,根据诊断准确性选择最佳模型。DL模型基于MRNet(图1),即先前在MRI[18]上用于诊断膝关节损伤的神经网络。MRNet是一个曾用于诊断膝关节核磁共振中损伤的神经网络算法,其骨架(backbone)为AlexNet。增强核磁共振的每一层图片均转化为三通道后,由AlexNet下采样,提取出256张7×7的特征图。特征图经全局平均池化(average pooling)转化为256个特征值。每个增强核磁的特征值经取每行最大值展平后由全连接层进行分类,最后输出良性和恶性的预测概率值。
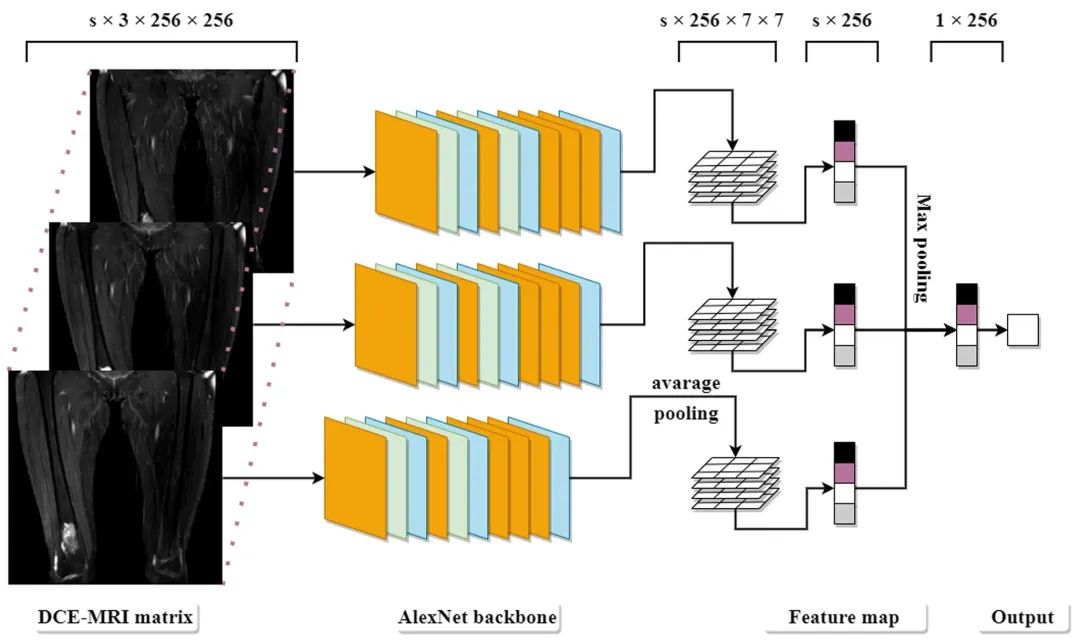
图1:MRNet以AlexNet为骨架构建可输出增强核磁良性和恶性的预测概率值
结果显示,对于细针穿刺活检,包含4604个样本的荟萃分析符合纳入标准,总体诊断准确率为0.77。对于核心针活检,综合7篇原始研究文章共587个样本的结果,得出总体准确率为0.86(表1)。
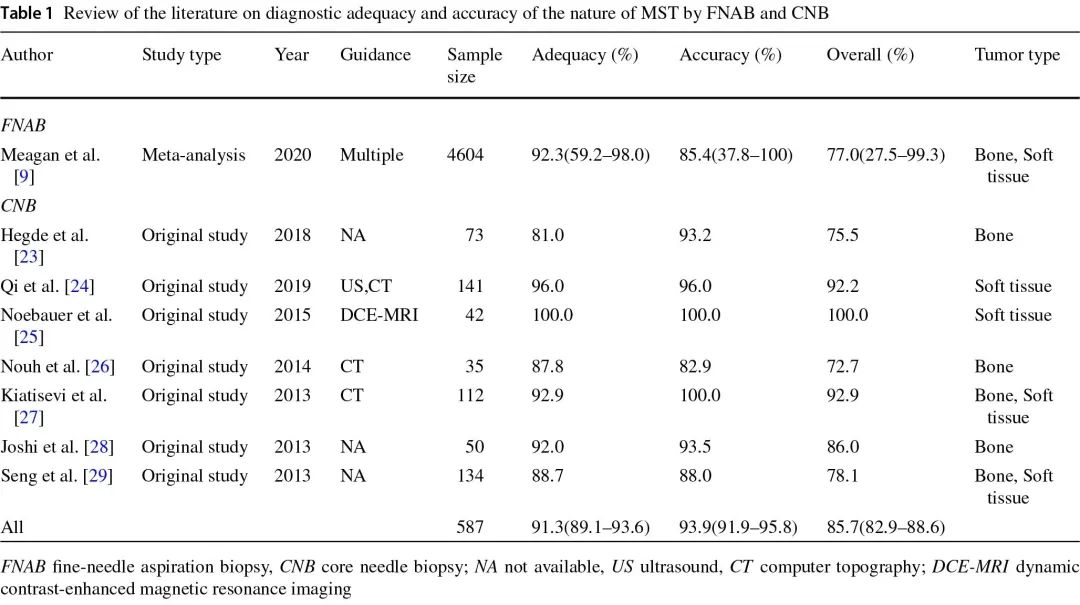
表1:通过FNAB和CNB回顾了关于MST诊断的充分性和准确性的文献
4名放射科医生的诊断准确性请见(表2)。在深度学习的辅助下,基于影像学的骨肿瘤良恶性鉴别准确率(4人,均>0.84),明显高于荟萃分析中报道的FNAB(0.77),与CNB相比,虽没有统计学差异,但是放射科医生“B到D”表现出更高的诊断准确性。放射科医师“A”的诊断准确性提高到FNAB和CNB之间的水平(图2)。
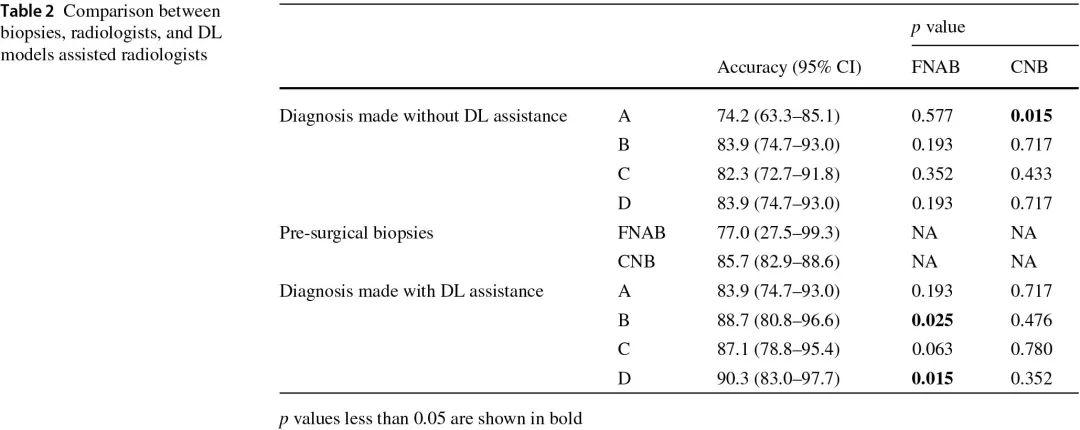
表2:放射科医生在深度学习辅助下和通过活检诊断的准确性对比
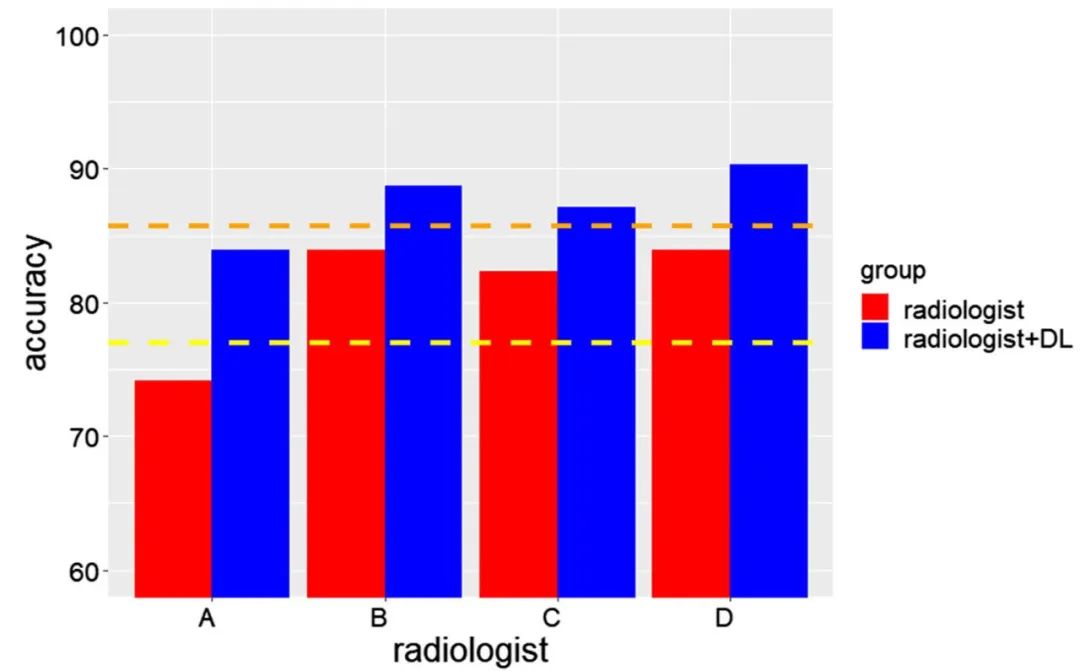
图2:总体诊断准确性的比较。黄色和橙色虚线分别表示FNAB和CNB的诊断准确性
在DL算法的帮助下,所有放射科医生在诊断敏感性方面都有显著改善:“A”0.17(95% CI 0.07–0.26,p=0.010),“B”0.10(95% CI 0.02–0.17,p=0.043);“C”0.07(95% CI 0.01 = 0.14,p = 0.017),“D”0.12(95% CI 0.04–0.20,p=0.002)(表3)。
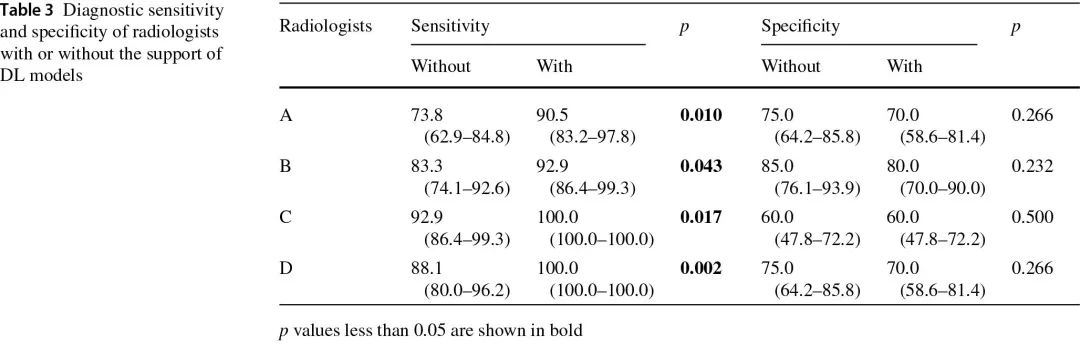
表3:放射科医生在有/无深度学习辅助下的诊断敏感性和特异性
综上所述,本研究表明:被邀请的放射科医生在深度学习辅助下,诊断肌肉骨骼肿瘤良恶性的能力可以提升至与文献中的术前活检相当的水平。该方法有助于减少恶性肿瘤漏诊,同时也可帮助避免部分本不必要的活检,降低有创操作的风险。
上海市第六人民医院与复星杏脉强强联手
深化创新,夯实基础研究
上海市第六人民医院骨科为国家骨科医学中心、国家级重点学科、卫生部临床重点专科、上海市“重中之重”临床医学中心,在骨关节创伤和骨病的诊疗方面具有独特的优势,骨肿瘤外科每年良、恶性骨肿瘤手术量达 2000余例。
复星杏脉在2017年“肺结节平均召回率96.6%”刷新国际权威的医疗影像大赛LUNA排行榜,获得双榜冠军、2019年“一致性系数94.6%”荣登国际权威全球病理竞赛Cancer Cellularity Challenge冠军榜首、2021-MICCAI-FLARE腹部多器官的分割任务中获得冠军。目前累计SCI发表的科研文章影响因子总计342.4分,国内外发明专利已经多达110余项,累计获得省市级以上项目、基金超过50项,其中国家级项目10余项,如科技部2030人工智能重点发展专项、国家十四五重大专项、国家973重大专项等。复星杏脉始终坚信科研必须和临床紧密联系,深化创新,夯实基础研究,才能完成产学研一体化建设,使得真正的应用场景得到落地,实现AI驱动的医疗科技服务,结合更多的产业生态的医疗服务、硬件,落地AI产品和技术,服务百姓和患者,实现“人工智能缔造全球10亿家庭健康生活”的使命。
复星杏脉
人工智能缔造全球10亿家庭健康生活
复星杏脉作为复星旗下首个独立孵化的人工智能企业,是一家专注于医疗人工智能的高科技公司。公司秉承“人工智能缔造全球10亿家庭健康生活”的使命,通过科技创新推动循证医学向精准医学的跨时代飞跃。
公司自2017年成立以来一直保持高速发展的趋势。复星杏脉是目前国内率先完成一横一纵的完整产研布局的公司,一横是助力医院影像科、病理科、超声科、呼吸科、心内科、肿瘤科等“医技+临床科室”横向贯通;一纵是软硬件整体方案覆盖“早筛、早诊、早治、随访”全流程。复星杏脉多款产品协助医院打通不同医技科室与临床科室协同应用的痛点,建立以患者为中心的诊疗一体化中心,提升医院流程效率以及精准化治疗,让更多的患者获益。
复星杏脉目前涵盖“顶级三甲医院”、“基层医疗”以及“智慧医疗”。针对头部三甲医院,软硬一体、AI辅助诊断、MDT诊断及方案将大大降低人员重复劳动的需求,提升科室运营效率;针对基层医疗,通过智能化的区域医共体建设,解决基层人才短缺问题,让分级诊疗切实落地;针对智慧医疗,通过与医学大中心的合作研发具备三类医疗资格的产品,协助智慧医疗真正进入诊疗体系,塑造未来智慧化医院治疗场景。

文献参考:
WHO Classifification of tumors Editorial Board (2020) WHO classifification of tumors of soft tissue and bone, 5th edn. IARC Press, Lyon
Ferrari A, Dirksen U, Bielack S (2016) Sarcomas of soft tissue and bone. Prog Tumor Res 43:128–141.https://doi.org/10.1159/ 000447083
He Y, Pan I, Bao B, Halsey K, Chang M, Liu H, Peng S, Sebro RA, Guan J, Yi T, Delworth AT, Eweje F, States LJ, Zhang PJ, Zhang Z, Wu J, Peng X, Bai HX (2020) Deep learning-based classifification of primary bone tumors on radiographs: apreliminary study. EBioMedicine 62:103121. https://doi.org/10.1016/j.ebiom. 2020.103121
Widhe B, Widhe T (2000) Initial symptoms and clinical features in osteosarcoma and Ewing sarcoma. J Bone Joint Surg Am82(5):667–674. https://doi.org/10.2106/00004623-200005000-00007
Zhao K, Zhang M, Xie Z, Yan X, Wu S, Liao P, Lu H, Shen W, Fu C, Cui H, Fang Q, Mei J (2021) Deep learning assisted diagnosis of musculoskeletal tumors based on contrast-enhanced magnetic resonance imaging. J Magn Reson Imaging.https://doi.org/10.1002/jmri.28025
1.本文内容仅供专业人士学术交流之用。
2.本文所述内容若涉及禁忌内容或注意事项,详见产品说明书。更多信息,请联系:aitrox@fosun.com